
Gerhard Mehrke
Neu-Ulm
mRNA-Impfung gegen Krebs
Seit einiger Zeit ist eine neue Form der Tumortherapie in den Fokus der Öffentlichkeit gerückt. Eine Therapie basierend auf Impfstoffen auf mRNA-Basis. Impfstoffe gegen Viruserkrankungen auf mRNA-Basis sind im Zuge der Covid-!9 Pndemie in Rekordzeit entwickelt und zur Marktreife gebracht worden. Dies war jedoch nur möglich, da es bereits intensive Vorarbeiten in dieser Technik gab, die zum Ziel die Bekämpfung von Tumoren hatten.
Die Entwicklung dieser Art von Tumorbekämpfung ist inzwischen weiter fortgeschritten und erste erfolgversprechende Anwendungen gibt es. Wie ist der Mechanismus dieser mRNA-Tools? Sie sollen das Immunsystem in die Lage zu versetzen, den Tumor zu erkennen und zu bekämpfen, also zum Beispiel mit Antikörpern und spezifischen T-Zellen, die sich gegen die Krebszellen richten. Es soll somit das körpereigene Immunsystem aktiviert werden. Man nimmt an, dass bei jedem Menschen tagtäglich bei den Zellteilungen durch Mutationen potenzielle Krebszellen entstehen. Diese werden in der Regel vom Immunsystem unmittelbar erkannt und zerstört. In seltenen Fällen aber gelingt es den Krebszellen sich zu tarnen und entkommen so der Immunabwehr. So können sie sich ungehindert vermehren, eine Tumorerkrankung entsteht. Die Impfung soll dem Immunsystem wieder beibringen, dass die Tumorzellen „fremd" sind und bekämpft werden müssen.
Im Vergleich zu einer herkömmlichen Impfung wird der eigentliche Impfstoff nicht im Labor produziert, sondern der Organismus produziert ihn selbst. Dazu benötigt er aber eine „Bauanleitung“, die wird in Form der mRNA geliefert. Bei der Corona-Impfung zum Beispiel stellen nach der Injektion der mRNA die Zellen das Protein her, das Bestandteil Oberfläche des Virus ist. Das Immunsystem erkennt dies und aktiviert seine Abwehrmechanismen. Tumorzellen – Tumorantigene Bei einer Impfung gegen Krebs wird ein Bauplan für ein Protein, das für diesen Tumor spezifisch ist (Tumorantigen) verwendet. Dazu müssen zuerst die charakteristischen Unterschiede der Tumorzellen gegenüber den gesungen Körperzellen analysiert werden. Dies geschieht über DNA-Analysen. Das heißt, es wird für jeden Tumor, möglicherweise sogar für jeden Patienten, ein individueller, genau angepasster Impfstoff entwickelt, der dann hocheffizient sein sollte. Es gibt natürlich bestimmte Voraussetzungen damit ein Tumor auf diese Art der Behandlung anspricht.
Eine entscheidende Frage ist, ob der jeweilige Tumor überhaupt die entsprechenden Veränderungen aufweist, die sich für diesen Ansatz eignen. Das unterscheidet sich bei den verschiedenen Krebsarten sehr stark und auch von Patient zu Patient. Es nicht immer einfach, geeignete Zielstrukturen zu finden. Noch ist nicht gut geklärt, welche Eigenschaften eine Struktur haben muss, damit sie für diese Therapie infrage kommt. Bei verschiedenen Studien hat die Auswahl der Zielstrukturen bislang gut funktioniert. Aber ist noch viel im Gange um dies Verfahren weiterzuentwickeln. Im Idealfall finden sich gleich mehrere geeignete Veränderungen, sodass man die zugehörigen Baupläne in einer Impfung kombinieren könnte, um die „Trefferquote“ zu erhöhen.
Immunsystem aktivieren
Eine zentrale Frage ist, wie es überhaupt möglich ist, das Immunsystem gegen eine Struktur zu aktivieren, die es ja eigentlich schon aus dem Kontakt mit den Krebszellen kennen sollte. Was hat dazu geführt, dass das Immunsystem sie nicht mehr als „fremd" erkennt, sondern toleriert. Bei bestimmten Tumoren können die Immunzellen gar nicht zu diesen vordringen, der Tumor kapselt sich ein. Wenn die Immunzellen diese Barriere nicht überwinden können, ist auch die Impfung sehr wahrscheinlich wirkungslos. Dann können eventuell andere Therapien vorgeschaltet werden, die dabei helfen, diese Barriere zu durchbrechen. Bei Tumorzellen, die die Immunzellen zwar erreichen können, aber nicht angreifen, ist die Impfung vielversprechend. Der Impfstoff muss dann so konstruiert sein, dass der Körper das Signal erhält, hier besonders aktiv zu werden. Die Zielstruktur bekommt dann sozusagen das Etikett „besonders gefährlich". Hierzu wird der mRNA-Impfstoff speziell ausgelegt. In Kombination mit dieser Tumorantigen-Impfung wird auch eine Aktivierung der für die Tumorzellbekämpfung wichtigen T-Zellen durch genetische Veränderung erforscht. Beides zusammen könnte die Wirksamkeit multiplizieren.
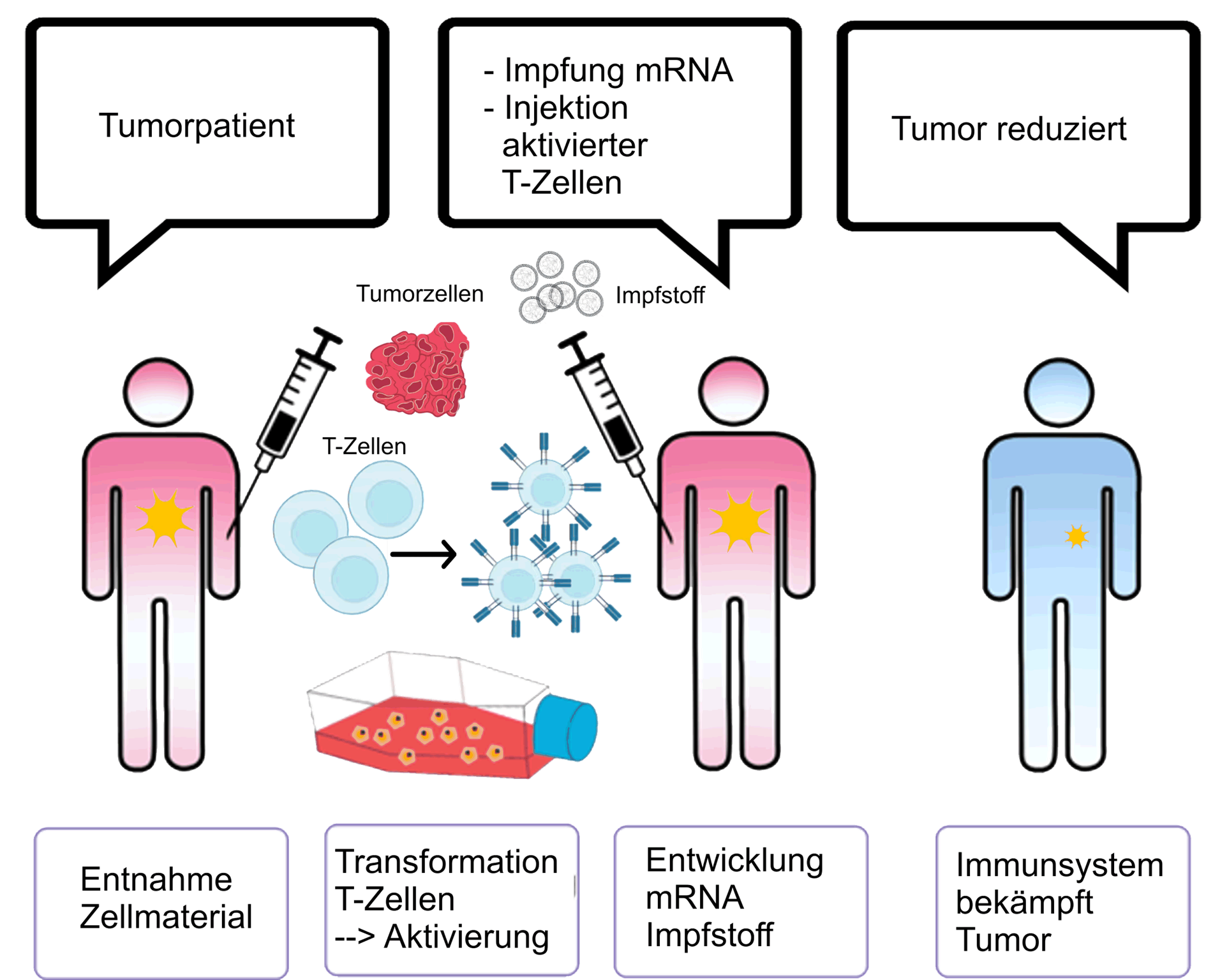
Abbildung:
gemenu 2023
Anwendungen
Die Entwicklung ist hier immer noch am Anfang, es liegen aber erste Ergebnisse vor, die darauf hindeuten, dass die Impfung gegen Krebs wirksam sein kann. Große klinische Studien sind bereits im Gange, die zeigen sollen, für welche Patienten die Impfung einen Vorteil bringt und für welche nicht. Es benötigt sicher noch mehrere Jahre, bis entsprechende Ergebnisse vorliegen. Die Impfung ist aber sicher keine Wunderwaffe, mit der sich nun alle Arten von Krebs bekämpfen lassen. Große Hoffnung gibt es zum Beispiel bei Patienten, bei denen der Tumor operativ entfernt wurde, wobei vielleicht einzelne Tumorzellen im Körper zurückgeblieben sind. Da kann das Immunsystem natürlich effizienter eingreifen als bei Patienten, bei denen sich unglücklicherweise vielleicht schon große Metastasen gebildet haben und die somit eine viel größere Tumorlast haben.
Letztlich kann die Impfung auch nur dann erfolgreich sein, wenn das Immunsystem überhaupt in der Verfassung ist, den Tumor zu bekämpfen. Das ist leider nicht bei allen Patienten der Fall. In Kombination mit anderen Therapien kann die Impfung aber durchaus sinnvoll sein. Hier sind noch entsprechende weitere Studien nötig.
Klinische Studien
Erste Erfolge in klinischen Studien meldete kürzlich die durch die Entwicklung der mRNA-Coronaimpfstoffe bekannt gewordene Firma Biontech. In dem Therapieansatz erhalten Patientinnen und Patienten eine Impfung mit einem mRNA-Impfstoff gegen das CLDN-6 Molekül. Das sogenannte onkofötale Antigen Claudin-6 (CLDN-6) kommt eigentlich nur während der Embryonalentwicklung im Mutterleib vor, aber auch bei bestimmten Tumoren.
Kombiniert wird die Impfung mit einer genetischen Editierung von sogenannten CAR-T-Zellen*. Diese Immunzellen sind gegen spezifische Eiweiße auf der Oberfläche von Krebszellen ausgerichtet, in diesem Fall von CLDN-6 Molekülen. In den bisher vorliegenden Studien konnte das Krebswachstum bei 74 Prozent der Versuchspersonen aufgehalten werden. Das Zielmolekül in dieser Therapie, das Eiweiß CLDN6 ist vielversprechend, da es bei verschiedenen Tumoren vorkommt, unter anderem bei Eierstockkrebs, bei Formen von Weichteiltumoren (Sarkome), Hodenkrebs, Gebärmutterkrebs und Magenkrebs.
* Bei der CAR-T-Zell-Therapie werden T-Lymphozyten genetisch verändert (CAR steht für „Chimärer Antigen-Rezeptor“). Dabei werden T-Lymphozyten aus dem Blut von Patienten entnommen und im Labor so transformiert, dass sie zahlreiche tumorspezifische Kontaktmoleküle (Rezeptoren) auf ihrer Oberfläche bilden. Die Struktur dieser artifiziell erzeugten Rezeptoren passt zur Oberfläche der zu bekämpfenden Tumorzellen wie ein Schlüssel zu einem Schloss. Mit ihnen sollen sie gezielt an die Tumorzellen andocken, um sie zu zerstören.
.